Konsep Laju Reaksi
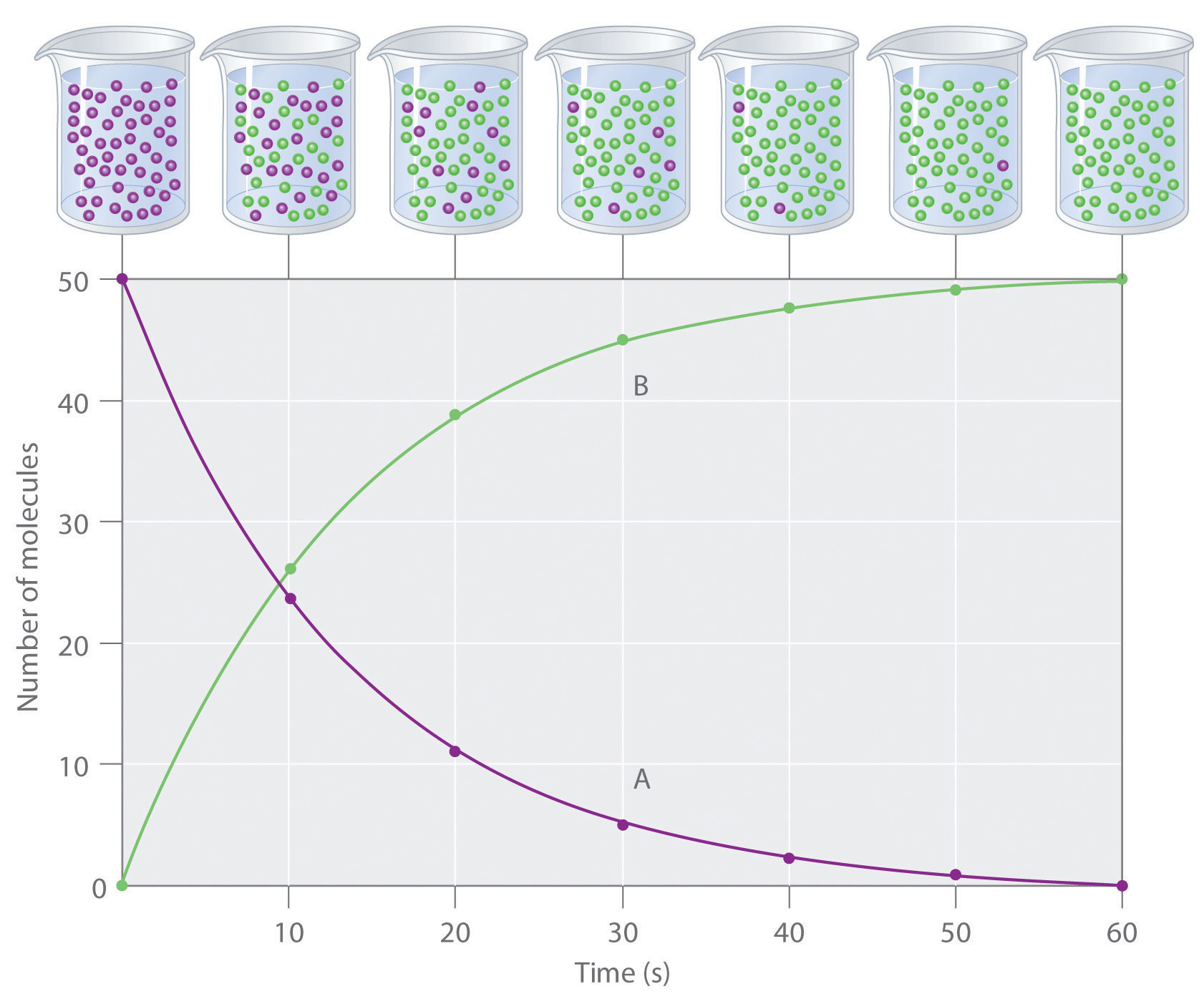
Laju reaksi atau kecepatan reaksi untuk reaktan atau produk dalam reaksi didefinisikan sebagai seberapa cepat atau lambat suatu reaksi dapat terjadi. Reaksi yang berbeda bisa terjadi pada tingkat yang berbeda. Reaksi yang terjadi perlahan memiliki tingkat reaksi yang rendah. Reaksi yang terjadi cepat memiliki tingkat reaksi yang tinggi. Misalnya, proses perkaratan besi di udara adalah reaksi lambat yang bisa memakan waktu bertahun-tahun, namun reaksi pembakaran bahan bakar seperti gas elpiji adalah reaksi cepat yang terjadi dalam hitungan detik.Contoh laju perubahan pereaksi A menjadi produk B per satuan waktu dapat dilihat pada gambar di bawah ini.
 |
| Konsep Laju Reaksi (http://chem.libretexts.org) |
- jumlah molekul A yang berkurang per satuan waktu, atau
- jumlah molekul B yang bertambah per satuan waktu.
Mg(s) + 2HCl(aq) ---> MgCl2(aq) + H2(g)
Laju reaksi dapat ditentukan dengan mengukur jumlah magnesium (Mg) atau asam klorida (HCl) yang digunakan dalam waktu tertentu atau jumlah magnesium klorida (MgCl2) atau gas hidrogen (H2) yang terbentuk dalam waktu tertentu.
Mengukur jumlah pereaksi atau hasil reaksi untuk menentukan laju reaksi
Dalam beberapa reaksi, pereaksi dan hasil reaksi dalam keadaaan bercampur dengan wujud yang sama misalnya larutan dengan larutan. Untuk memisahkan kedua komponen tersebut cukup sulit. Oleh karena itu, pengukuran laju reaksi akan lebih mudah dilakukan pada reaksi dengan wujud hasil reaksi berbeda dengan pereaksinya. Pengukuran laju reaksi yang menghasilkan gas seperti pada contoh di atas dapat dilakukan dengan mengukur volume gas yang terbentuk dalam waktu yang ditentukan atau mengukur massa campuran pereaksi dan hasil reaksi setelah beberapa waktu yang ditentukan. Adapun cara lain yang dapat dilakukan untuk menentukan laju reaksi adalah melalui perubahan massa. Cara ini cocok untuk reaksi yang menghasilkan gas dengan massa cukup tinggi seperti CO2, misalnya pada reaksi antara CaCO3 dengan HCl persamaan reaksi sebagai berikut:CaCO3(s) + HCl(aq) --> CaCl2(aq) + CO2(g) + H2O(l)
Faktor - Faktor yang Mempengaruhi Laju Reaksi
Adapun faktor - faktor yang dapat mempengaruhi laju reaksi adalah sebagai berikut:
Konsentrasi perekasi / reaktan
Konsentrasi reaktan yang lebih tinggi menyebabkan tabrakan lebih efektif per satuan waktu, yang menyebabkan laju reaksi meningkat (kecuali reaksi orde nol). Demikian pula, konsentrasi produk yang lebih tinggi cenderung dikaitkan dengan laju reaksi yang lebih rendah.Suhu
Umumnya, kenaikan suhu selalu disertai dengan kenaikan laju reaksi. Suhu adalah ukuran energi kinetik suatu sistem, sehingga suhu yang lebih tinggi mengindikasikan energi kinetik rata-rata yang lebih tinggi dari molekul dan lebih banyak tumbukan per satuan waktu. Aturan umum umum untuk sebagian besar (tidak semua) reaksi kimia adalah bahwa laju reaksi berlangsung kira-kira dua kali lipat untuk setiap kenaikan suhu 10°C. Begitu suhu mencapai titik tertentu, beberapa zat kimia dapat berubah (misalnya denaturasi protein) dan reaksi kimia akan melambat atau bahkan berhenti.Luas permukaan dan wujud zat
Tingkat reaksi kimia bergantung pada media di mana reaksi tersebut terjadi. Terdapat perbedaan laju reaksi antara pelarut berair atau organik, polar atau nonpolar, atau antara pereaksi berupa cairan, padatan, dan gas. Reaksi yang melibatkan cairan dan padatan bergantung pada luas permukaan sentuh. Untuk padatan, bentuk dan ukuran reaktan berpengaruh terhadap laju reaksi. Semakin luas permukaan sentuh, semakin cepat laju reaksi terjadi, begitu juga sebaliknya.Katalis
Katalis dapat menurunkan energi aktivasi reaksi kimia dan meningkatkan laju reaksi kimia tanpa mengalami perubahan oleh reaksi itu sendiri. Katalis bekerja dengan meningkatkan frekuensi tumbukan antara reaktan, mengubah orientasi reaktan sehingga tumbukan lebih efektif, mengurangi ikatan intar molekul di dalam molekul reaktan, atau menyumbangkan kerapatan elektron ke reaktan.Tekanan (Update)
Share This :

comment 0 Komentar Yang Masuk
more_vert